Hasnyálmirigy-mucinus cisztás neoplazma
Kapcsolódó kifejezések:
Tudjon meg többet a Hasnyálmirigy-mucinus cisztás neoplazmáról
Máj és hasnyálmirigy
Muciinus cisztás daganat
A nyálkás cisztás daganatok az elsődleges hasnyálmirigy daganatok 5,7% -át teszik ki, 90:10-es női-férfi arány mellett, átlagéletkor 40 és 50 év között. 101,102 A mucinos cisztás neoplazmák kb. 70-90% -a a hasnyálmirigy testében vagy faránja. A daganatok általában multiloculáltak, vagy ritkán, unilokuláltak. A CT-vizsgálatok általában vastag falú cisztás masszát mutatnak a csatorna-rendszerhez való csatlakozás nélkül. Hisztológiailag a cisztákat magas oszlopos sejtek bázissal bázisos magokkal és bőséges intracitoplazmatikus apikális mucinekkel sima lapok vagy papilla, gyakran petefészek-típusú sztrómával borítják. A nyákos cisztás daganatok adenomának, határvonalnak, karcinóma in situ és invazívnak minősülnek a bélhám epitelium dysplasia vagy a stromalis invázió jelenlétében. Körülbelül egyharmadát invazív ductalis carcinoma társul. Az üregek nyálkahártyát tartalmaznak, és magas, mucin-termelő hámsejtek bélelik (28.72 ábra). Bár jóindulatú és rosszindulatú fajták léteznek, a jóindulatú és rosszindulatú daganatok közötti különbség nem mindig egyértelmű, és kiterjedt mintavételt igényel a tumorról. Ezért minden ilyen mucinus daganatot potenciálisan rosszindulatúnak kell tekinteni. A “mucinos cisztadenómák”, mint a cisztadenokarcinóma, jól dokumentáltak. Ezért a tumorok teljes kivágása erősen ajánlott.
A aspirátumok általában nagyon sejtesek a mucinos háttérben, legjobban a Romanowski foltban (28.73. Ábra). Az aspirált nyálkahártyából készült citológiai kenetek számos epiteliális sejtet mutatnak, amelyekben az endocervix benignus sejtjei hasonlítanak a vacuolált citoplazmához. 106,107 A tumorsejtek papillárisan (28.74. Ábra) vagy méhsejt mintával (28.75. Ábra) vagy egyedileg, gyakran tűzőcellákként jelennek meg. A magok kerek vagy tojásdagúak, és kis nukleoluk lehetnek. A határvonalbeli daganatokban, in situ vagy mucinos cystadenocarcinomákban az atipikus hámsejtek közösek. Ezek nagyobbak, és a nukleocitoplazmatikus arány magasabb. A magok gyakran mutatják a méretváltozásokat, és szembetűnő nukleolikumokat és finoman szemcsés vagy enyhén durva kromatint tartalmaznak. Bizonyos esetekben rosszindulatú transzformációt mutató atipikus hámsejteket észleltek. Ezek a rendkívül rendellenes sejtek, amelyeknek nagy méretű és alakú változatai vannak, és kismértékben durva kromatin fordul elő rendszertelenül.
Klinikai: elsősorban középkorú nők, alkalmi férfiak.
CT-vizsgálat: Vastagfalú, multiloculált cisztás tömeg a hasnyálmirigy testének faránál a ductalis rendszerhez való csatlakozás nélkül.
Bőséges mucin, amely epitélium papilláris töredékeit tartalmazza.
Oszlopos sejtek finoman finom kromatinnal és apró nukleollal rendelkező, óvatos ovális magokkal.
A tüdő jóindulatú daganata
Klinikai szolgáltatások
A tüdő nyálkahártya-neoplazmái a mucinális cisztadenómától a kolloid adenokarcinómáig terjedő tumorok szövettani spektrumát foglalják magukban. Ezek a szervezetek ritkák, és bár az egykori lézió jóindulatú, a mucinos cystadenokarcinóma egyértelműen rosszindulatú (lásd a 26. fejezetet). A mucinus cystadenoma a felnőttek tumora a hatodik és hetedik évtizedben. A legtöbb esetben beszámoltak a dohányosokról; mégis nincs etiológiai kapcsolat. A betegek tünetmentesek, és a daganat véletlenszerű, lekerekített, jól körülhatárolt tömegként jelenik meg a röntgensugárzás és számítástechnika (CT) vizsgálatának meszesedése nélkül. Habár a minimálisan invazív diagnosztikai eljárások nyálkahártyát vagy csomós sejtek csoportját eredményezik, a diagnózis érdekében műtéti kivágás és teljes szövettani mintavétel szükséges.
Patológiai jellemzők
Bruttó megállapítások
Ezek a tumorok egyszilokuláris, csillogó, szürke, nyálkahártyával teli ciszták, amelyek mérete 0,8 és 5,0 cm között van, és nincsenek falikarok.
Mikroszkopikus eredmények
Az egyszerű unilocularis cisztust nyálkahártyával töltöttük, és a szálas szövetfalat egy folytonos, alacsony kocka alakú, magas oszlopos sejtekkel béleltük meg, jelentős citoplazmatikus mucinnal (31.7A és B ábra). A magok alapvetően helyezkednek el, de fókuszos pszeudostratifikáció látható. A magok kerek vagy lapos, és a nucleoli nem észrevehető. A torzítás papilláris levéleket javasolhat, de az igazi papilla, a nekrózis és a citológiai atipia nem látható. A ciszta falának nem tapasztható részei általában idegen testű óriássejtreakciót és lymphoplasmacytás infiltrátumokat tartalmaznak. A környező tüdő gyakran gyulladt és atelektikus.
Kiegészítő tanulmányok
Immunohisztokémia
A mucinos epitélium citokeratin és CK7 pozitív, és általában CK20 és TTF-1 negatív.
Megkülönböztető diagnózis
A mucinális cisztadenomákat különböztetni kell a nyílt rosszindulatú daganatoktól, beleértve az invazív mucin adenokarcinóma és a kolloid adenokarcinóma, valamint a fejlődési és utókezelési elváltozásokat. Mikropapilláris levél, a tumorsejtek terjedése a ciszta falán túl, a mucinban lebegő tumorsejtek, a túlzott citológiai atipia vagy a nekrózis rosszindulatú diagnózisra utal. A CK7-pozitivitás segítséget nyújthat az áttétes vastagbél daganatokban előforduló primer tüdő megkülönböztetésében, de ezeknek a mucinális daganatoknak az immunhisztokémiai profilja tükrözi a colorectalis neoplazmákét. Az invazív mucinális adenokarcinóma emphysematous parenchyma vonalat mutathat, és cisztásnak tűnik, de mindig lepid növekedést mutat. Az intrapulmonáris bronchogén ciszták középvonallal rendelkeznek, és legalább részben lyukacsos oszlopos hámmal vannak bélelve, és a rostos szöveti fal is tartalmaz porcokat és / vagy szeromuzin mirigyeket.
A para-tápláló traktus fejlesztése, differenciálása és betegsége
Aláírási mutációk időbeli felhalmozódása a PanIN-PDAC Progresszió során
Három neoplasztikus, nem invazív prekurzor elváltozást észleltek PDAC-hoz: (1) IPMN, (2) mucinous cystic neoplasma (MCN) és (3) PanIN. A PanIN-ok a legelterjedtebbek, és a boncolási adatok alapján az egyének akár 16-28% -át is azonosítják. 144,145 A PanIN elváltozások előfordulási gyakorisága és súlyossága fokozódott az életkorral, és – amint azt korábban említettük – bizonyos betegségekkel, például krónikus hasnyálmirigy-gyulladással. A konszenzuskonferenciák a PanNIN-eket a növekvő rendellenességek kategóriái szerint osztályozták (4. ábra, 146-147. A PanIN1 elváltozások lapos (PanIN1A) vagy papilláris (PanIN1B) jellemzőkkel rendelkeznek, bár mindkettő jellemzője, hogy oszlopsív megjelenésű, a mucinális anyag felhalmozódásával és a sejtek bazális vonatkozásai mentén egyenletesen elhelyezkedő magokkal rendelkeznek. A PanIN2 elváltozásokat a celluláris polaritás és néhány nukleáris pleomorfizmus elvesztése alapján osztályozzák. A PanIN3 elváltozások komplex és heterogén struktúrákat mutatnak egyetlen lézióban, beleértve a papilláris és cribiform-szerű struktúrákat. A magok ebben a léziókban rendkívül pleiomorfak, véletlenszerűen orientáltak és nyilvánvaló mitotikus alakokat mutatnak.
A PanIN-képződés molekuláris alapját részben a génmódosított PDAC-modellek létrehozásával fedezték fel, amelyekben a PanIN-progresszió lépcsőzetes módon figyelhető meg, ami az emberi mintákban megfigyelhető aláírás-mutációk felhalmozódását tükrözi. A durva közelítéshez a Kras-mutációk aktiválása és a telomere-rövidítés jellemzi a PanIN1 elváltozásokat, az Ink4a elvesztése korrelál a PanIN2 képződéssel, míg a p53, a SMAD4, a BRCA2 és az LKB1 veszteség társul a késői szintű PanIN elváltozások és az őszinte PDAC kialakulásához. 123,148 A rendelkezésre álló bizonyítékok alapján a PanIN PDAC-hoz való előrehaladása egy kissé kiszámítható genetikai-hisztológiai szekvenciát követ, hasonlóan a jól ismert polipuk-karcinóma progressziós sémahoz, amelyet a colorectalis rák esetében ismertetnek. 149
A tumorfejlődés másik fontos tendenciája a sztróma drámai felhalmozódása, mivel a PanIN elváltozások az őszi karcinóma felé haladnak. Valójában a hasnyálmirigy-rák egyik megkülönböztető jegye a daganatellenes reakció. A stromális infiltrátum számos sejttípusból áll, beleértve a fibroblasztokat, makrofágokat és endothelsejteket. Mivel az interstitium elárasztja ezeket a sejteket, a mátrix és a fibrotikus anyag nagyon bőséges lesz, ami jelentős változásokat eredményez a hasnyálmirigy fizikai jellemzőiben. Ahogy a tumorok kialakulnak, a keményített csomók a mátrix-szekretáló sztrómának a malignus transzformációban szenvedő sejtekkel szomszédos lokális hiperaktívációjának eredményeképpen keletkeznek. Valószínű, hogy ez a desmoplasztikus válasz szükséges a tumor növekedésének és a metasztázisnak a felgyorsult természetéhez ebben a betegségben, és hogy a neoplasztikus mikrokörnyezet kondicionálásához fontos proliferációs utakon keresztül intercompartmentális keresztbeszélés szükséges.
A hasnyálmirigy-daganatok genomiális értékelése
A kiadói összefoglaló
A molekuláris analízis szerepe a hasnyálmirigyrák korai felismerésében és diagnosztizálásában vitatott. Ez a fejezet bemutatja a jelenlegi molekuláris képességeket a hasnyálmirigy-rák szűrésére, korai kimutatására és javított diagnózisára. A hangsúly a közvetlen klinikai alkalmazhatóságra irányul ebben a gyorsan fejlődő területen, ami a transzlációs kutatás mozgásban van. A mucinos cysticus neoplazmák (MCN) diagnózisát és értékelését, amelyek premalignus hasnyálmirigy ciszták vannak, vázolják fel, betekintést nyújtva a molekuláris prognózis és a tumor irányított génterápiához. A hasnyálmirigyrák olyan halálos betegség, ahol az éves prevalencia halálozással egyenlő. Mivel a legkorábbi szakaszban a felderítés biztosítja a legjobb esélyt a gyógyításra, a közelmúltbeli kutatási erőfeszítések a jobb diagnosztizálásra, a korai felismerésre és a hasnyálmirigyrák rákszűrésére irányultak. A molekuláris elemzés ebben a tekintetben igen érdekes területnek számított. A hasnyálmirigyrák túlnyomó többsége szórványos, nyilvánvaló genetikai kapcsolat nélkül. A sporadikus hasnyálmirigyrákra jellemző kockázati tényezők közé tartozik az életkor, a dohányzás, a krónikus hasnyálmirigy-gyulladás és a régóta fennálló diabetes mellitus. Ezenkívül az étrendi tényezők, mint például a hús és zsírok nagy bevitele növeli a kockázatot.
Molekuláris teszt a hasnyálmirigyrákban
M. Bartel 1,. M. Raimondo 1, a Diagnosztikai Molekuláris Pathology, 2017
Bevezetés
A hasnyálmirigy duktális adenokarcinóma (PDAC) pusztító betegség, magas halálozással. Az aktuális terápiás módszerek a PDAC-ben szenvedő betegeknek csak esélyt adnak a gyógyításra, ameddig a betegség a hasnyálmirigyre korlátozódik. A gyógyulás esélyei csökkennek a szomszédos hajóstruktúrák és a nyirokcsomók rákkal való érintkezésében, és végül a nem helyreállítható lokálisan előrehaladott rák és a távoli metasztázis jelenlétében végbélbetegségre lépnek. Ezért a jelenlegi cél a PDAC felismerése a legkorábbi szakaszokban. A hasnyálmirigyrákra vonatkozó diagnosztikai biomarkereknek nemcsak magas érzékenységgel, specifitással és pontossággal kell teljesíteniük ezt a kritériumot, hanem meg is tudják különböztetni a PDAC-t olyan egyéb hasnyálmirigy állapotoktól, amelyek megnövekedett kockázatot jelentenek a PDAC kifejlesztésére, de nem rendelkeznek invazív betegséggel a vizsgálat idején , hogy elkerüljék a felesleges invazív teszteket és műtéteket. Ezek a hasnyálmirigyrák többek között krónikus hasnyálmirigy-gyulladás, mucinos cisztás neoplazmák (MCN) és intraductalis papillary mucinous neoplasms (IPMN). Bár a genetikai elváltozásokat jól ismerték a krónikus hasnyálmirigy-gyulladásban, az MCN-ben és az IPMN-ben, ezeknek a sérüléseknek a PDAC-hoz való természetes előrehaladása nem teljesen ismert.
A legtöbb PDAC a hasnyálmirigy intraepithelialis neoplazia (PanIN) nevezett premalignus elváltozásokból származik, amelyek a morfológiai diszplázia és a genetikai mutációk felhalmozódása alapján további PanIN-1a, PanIN-1b, PanIN-2 és PanIN-3-ra vannak osztva. Ebben a kontextusban a Plectin-1-et a PanIN-3 elváltozások jelölőjeként írják le, amelyekről úgy gondolják, hogy a PDAC legkorábbi fázisai [1].
Az elmúlt három évtizedben a PDAC megfelelő diagnosztikai biomarkereinek keresése szorosan követte új biotechnológiai módszerek létrehozását. A korai módszerek ELISA és Western blotok alkalmazásával mutatták ki a fehérje biomarkereket. Ezt követően a PCR-t kifejlesztették, és hasznosnak találták a genetikai változások kimutatására. A legfrissebb kromatográfiás módszerek, a gén-chipek és a fehérje-chipek lehetővé teszik a széles körű keresést a diagnosztikai biomarkerekre, beleértve a genomszéles szűrést is. Legújabban a PDAC-t jelentős mértékben megváltoztatták epigenetikus változások, amelyek magukban foglalják a DNS metilációs státuszt, a hiszton poszttranszlációs módosításait és a mikroRNS expressziós szinteket.
Számos tanulmány kimutatta, hogy a biomarkerek paneljei növelik az érzékenységet, a specifitást és a diagnosztikai pontosságot a PDAC diagnosztizálásában és a krónikus hasnyálmirigy-gyulladásban és az IPMN-ben való diszkriminációjával [2-4]. Ez a megfigyelés valószínűleg tükrözi azt a tényt, hogy a PDAC jelentős heterogenitást mutat. Anatómiai elhelyezkedésük ellenére a rákok különböző biológiai hátterekkel rendelkezhetnek, amelyek tükrözik a tumorigenesis molekuláris útvonalát. A különféle molekuláris utakon kialakuló rákok különböző diagnosztikai biomarkereket igényelnek [5].
Metasztatikus hasnyálmirigy-rák
P. Martinelli 1, E. Lonardo 2 3, Bevezetés a rák metasztázisába, 2017
A hasnyálmirigy duktális adenokarcinóma genetikája és biológiája
Hisztológiailag a tipikus PDAC a csatornaszerű struktúrákat mutatja be bőséges dezmoplasztikus stromba ágyazva. A hisztológiai megjelenés és annak a ténynek köszönhető, hogy a pankreatikus duktális sejtek (pl. KRT7, KRT8, KRT18, KRT19) markereként expresszálódik, a PDAC klasszikusnak tekinthető normál ductalis sejtekből, ahol több genetikai változás halmozódik fel és hozzájárul a progresszív sejt transzformáció. Az egérmodellekből származó bizonyítékok azonban támasztják alá azt is, hogy a normál acinussejtek acinus-ductalis metaplasia (ADM) nevű metaplasztikus folyamaton keresztül (ductalis tumorok) is kialakulhatnak (Guerra et al., 2007). A hasnyálmirigyrákos betegeknél gyakran megfigyelhető az ADM (Brune et al., 2006).
A molekuláris patológiás vizsgálatok és a kiterjedt genomiális analízisek a PDAC-t egy olyan sokrétű progressziós modellt alakították ki, amely még mindig széles körben elfogadott (7.1. Ábra) (Maitra és Hruban, 2008, Hezel és mtsai, 2006), amellyel a genetikai elváltozások felhalmozódása a növekvő fokozatú preneoplasztikus léziók megjelenését idézi elő, majd előrehalad az áttörő invazív karcinóma. A leggyakoribb preneoplasztikus léziók a pancreas intraepithelialis neoplasia (PanINs), amelyek a minimális diszplázia (PanIN-1A és 1B) és a súlyos dysplasia (atropiás panin-2), in situ karcinóma (PanIN-3) és végül a PDAC-hoz (Maitra és Hruban, 2008). A PDAC-betegeknél leírt kevésbé gyakori preneoplasztikus elváltozások az intraductális papilláris mucinus neoplazmák és a mucinos cisztás neoplazma (Maitra és Hruban, 2008; Hezel et al., 2006).
A genetikai profilalkotási tanulmányok kimutatták, hogy a PDAC – k leggyakoribb változásai a KRAS oncogén (az esetek 95% -ában) és a tumorszuppresszorok inaktiválása CDKN2A (> 95%), TP53 (50-75%), és SMAD4 (55%) (Maitra és Hruban, 2008; Hezel et al., 2006). aktiválása KRAS mutációkat gyakran észlelnek a legalacsonyabb fokozat (legfeljebb 90%) és a PDAC nélküli szövetekben (Luttges és munkatársai, 1999, Kanda és mtsai, 2012) a PanIN-okban, ezért kezdeti eseménynek számítanak. Következetesen a mutáns hasnyálmirigy-specifikus expressziója KRAS a mesterséges egérmodellek elegendőek az egér PDAC (mPDAC) iniciálásához, bár a tumor progressziójához további genetikai elváltozások vagy pancreatitis indukcióra van szükség (Guerra et al., 2007; Bardeesy et al., 2006; De La et al., 2008; Guerra és munkatársai, 2003; Hingorani és munkatársai, 2005). Inaktiválása CDKN2A a legalsóbb minőségű PanIN-ekben is megfigyelhető volt, még akkor is, ha nincs KRAS mutációkat, alátámasztva azt a hipotézist, hogy ez egy korai esemény a PDAC iniciáció során (Kanda et al., 2012). Éppen ellenkezőleg, az inaktív mutációk a TP53 és SMAD4 a tumorszuppresszorokat csak a magasabb PanIn-2 és PanIN-3 szintekben észlelték, ami azt sugallja, hogy késői események, amelyek hozzájárulnak a PDAC progressziójához, nem pedig az iniciáláshoz.
Meg kell jegyezni, hogy a PDAC-progresszió linearitásának alátámasztására rendelkezésre álló bizonyítékok nem rendkívül erősek, és az alternatív útvonalak vezethetnek a PDAC kifejlesztéséhez különálló alacsony fokú elváltozásokból vagy akár közvetlenül a magas minőségű PanIN-kből (Real és mtsai. , 2008) (7.1 ábra). Az egysejtes szekvenálási technológiák a jövőben rávilágíthatnak erre a kérdésre.
Újabban az egész egzóma és az egész genom szekvenálási törekvései sokkal több összetett genomiális változást mutattak ki, amely a többszörös mag-jelátviteli utakat érintette (Jones et al., 2008; Waddell et al., 2015). Bár a PDAC genetika ma már igen jól ismeretes, az ilyen tudás klinikailag jelentős előrelépése még mindig kemény, mert a kevéssé változó gének bizonyultak nehézkes terápiás célmeghatározásra, míg a fennmaradó változások a
Molekuláris gasztrointesztinális, máj- és hasnyálmirigy-patológia
Bár a hasnyálmirigy-rák előfordulása 100 000 emberből csak 10, ez a negyedik vezető oka a rákos halálozásoknak az Egyesült Államokban, mivel a legtöbb beteg (80%) metasztatikus betegségben szenved. A tömör hasnyálmirigy-elváltozások diagnózisának előnyös módszere érzékeny (60-95%) és specifikus (100%) érzékeny endoszkópos ultrahangos és citopatológus kezében. A pancreas adenocarcinoma molekuláris patogenezise alapján kiegészítő diagnosztikai technikákat javasoltak; azonban egyetlen molekuláris rendellenesség sem alkalmazható az összes hasnyálmirigy-karcinóma pontos diagnosztizálására, mivel a hasnyálmirigy-neopláziák többszörös útjai vannak. Úgy tűnik, hogy a ductalis adenokarcinóma a PanIN-1A-tól a PanIN-3-ig terjedő preinvazív elváltozásokon alapul. A korai preinvazív elváltozások mutációkat mutatnak be KRAS és p21, míg a mutációk a TP53, p16 INK4A, DPC4 / SMAD4, és BRCA2 viszonylag késői eredmények. A telomeráz aktivitás növekedése szintén gyakori a hasnyálmirigy duktális adenokarcinómákban. A telomeráz fontos enzim, amely DNS-ismétlést ad a kromoszómák vége felé telomerek. A rövid telomerek a replikációs öregedést jelzik; így a megnövekedett telomeráz aktivitás eredményeképpen létrejövő hosszú telomerek elősegíthetik a tumorigenezist.
Az intraductális papilláris mucinus tumorokkal összefüggésben fellépő invazív elváltozások különböző molekuláris útvonalon keletkezhetnek, mint a ductalis adenokarcinómák, mivel a p16 INK4A, SMAD4, és TP53 viszonylag ritka, bár KRAS a mutációk és a megnövekedett telomeráz aktivitás a léziók nagy arányában fordul elő. Bizonyíték van arra, hogy az intraductális papilláris mucinus tumorokban a rosszindulatú transzformáció a tumorszuppresszor gén promóterek CpG-sziget-metilezésén keresztül folytatódhat. A mucinos cisztás neoplazmák molekuláris progressziójáról kevés ismeretes.
A hasnyálmirigy-rák örökletes formái is léteznek. Betegek a BRCA2 a mutációk, a PJS és a diszpláziás nevus szindróma a hasnyálmirigy-rák fokozott kockázatát hordozza az általános populációban. Nemrégiben mutáció egy új génben, PALLD, amely a palladin fehérjét kódolja, egy olyan családban íródott le, amelynek az autoszomális domináns módon öröklődő hasnyálmirigy-rák előfordulási gyakorisága volt. A palladin a citoszkeleton keretet alkotó komponensként funkcionál, és sok hasnyálmirigyrákos sejtvonalban, valamint bizonyos sporadikus karcinómákban túlexpresszálódik, és új jelenséget jelenthet a hasnyálmirigyrákra.
Molekuláris tesztek, amelyek a KRAS mutációkat és fokozott telomerázaktivitást fejlesztettek ki, de sok diagnosztikai laboratóriumban rutinszerűen nem állnak rendelkezésre. 12 – es kodon mutációk szűrése KRAS, valamint a heterozigóziás elemzés veszteségét hat tumorszuppresszor lókuszban (retinoblasztóma kölcsönható cink ujj, von Hippel-Lindau, APC, p16 INK4A, PTEN és TP53) képes volt a hasnyálmirigy-adenokarcinóma és a kolangiokarcinóma összes esetének szétválasztására gyulladásos állapotokról egy közelmúltbeli vizsgálatban. Azonban más kutatók találtak KRAS a krónikus hasnyálmirigy-gyulladás mutációi, amelyek megkérdőjelezik a diagnosztikai marker használatát. Két újabb tanulmány szerint a ploiditás FISH-analízise, valamint a Feulgen-festék beépítésével kapott DNS-tartalom hasznos lehet, ha a hagyományos citológiai elemzés kétértelmű eredményt hoz. Ezeknél a vizsgálatoknál a FISH 7-es triszómiája és 1,89-nél nagyobb DNS-tartalma nagyon rosszindulatú volt. A kromoszomális nyereségeket vagy veszteségeket azonban óvatosan kell értelmezni, mivel a krónikus pancreatitisben szenvedő betegek kóros sejtjei kromoszóma instabilitást mutattak.
A megnövekedett telomerázaktivitás az invazív adenokarcinóma pontosabb markere, hiszen nem bizonyított, hogy gyulladásos betegségekben növekedett. A telomeráz aktivitást kvantitatív valós idejű reverz transzkriptáz PCR-rel vagy egy félkvantitatív telomerikus ismétlődő amplifikációs próbával lehet mérni. Ezekben a molekuláris vizsgálatokban kis mennyiségű fehérjét izolálnak citológiai mintából, hogy a telomerikus ismétléseket DNS-szubsztrátumra szintetizálják. A módosított szubsztrátot ezután PCR-reakcióban amplifikáljuk. A PCR-termékek növekvő mennyisége korrelál a telomerázaktivitás szintjével a mintavételes lézióban. Egy vizsgálatban a semikvantitatív telomeráz-vizsgálat alapján a rosszindulatú daganatok kimutatására szolgáló érzékenység 100% -os specificitással 79% volt. Fontos megjegyezni, hogy a hét hasnyálmirigy-adenokarcinoma közül hat, amelyekben a citológia negatív volt, megnövekedett telomerázaktivitást találtunk. Így a citometriai elemzés, a telomeráz aktivitás mérése és KRAS hamarosan mutációkat használnak az endoszkópos ultrahangvizsgálat érzékenységének növelésére.
mikroRNS biomarkerek potenciális diagnosztikai markerek a rák
A cisztás sérülések diagnózisának és kezelésének javítása
A hasnyálmirigy cisztás neoplazmákat gyakrabban fedezik fel a nagy felbontású radiológiai képalkotás alkalmazásának növekedése miatt a hasi trauma és egyéb rendellenességek értékeléséhez [95]. A képalkotás során azonosított nem-tapasztalt, tünetmentes hasnyálmirigy-ciszták prevalenciája akár 2,6% lehet [96]. A PDAC leggyakoribb cisztás prekurzor elváltozásai az intraductalis papillary mucinous neoplasms (IPMN). Azonban a jelenlegi preoperatív módszerek, köztük a képalkotás, az endoszkópia és a biokémiai cisztás folyadék-analízis nem tudják pontosan megítélni a ciszták diszpláziaszintjét és az invázió jelenlétét anélkül, hogy reszekciót és pontos hisztopatológiai vizsgálatot végeznének. Például a CT és MRI képalkotó funkciók csak 50% -os diagnosztikai pontossággal rendelkeznek. Az EUS csak az esetek mintegy 50% -ában tudja megkülönböztetni a nem mucinos elváltozásokból származó mucinokat [97-100], ami azért fontos, mert a mucin a malignus potenciálú léziókra jellemző, mint például az IPMN és a mucinos cystic neoplasms (MCN). Az aspirált cisztás folyadéknak az FNS-ből történő citológiai értékelése gyakran az EUS-ben történik, de a legjobb 50% -os teljes pontossággal rendelkezik, ami drámaian csökken a kisebb hasnyálmirigy-cisztákban [98,101-103]. A mucinos elváltozások hámhártyájában szekretált glikoprotein tumor antigének, mint például a carcinoembryonic antigén (CEA) kimutatására a CEUC> 192 ng / ml-es mucinális cisztás léziók esetében a szenzitivitás és specifitás 75% és 84%. Azonban sok mucinos elváltozás a CEA-val
A hasnyálmirigy lóg a felső hasban. Időnként rákos megbetegedések jelentkeznek, amelyek közül a leggyakoribbak nagyon halálosak.
A hasnyálmirigy – citopathológiát a gasztrointesztinális citopatológia cikk.
A gasztrointesztinális patológia általános ismertetője a gastrointestinalis patológia cikk.
Bevezetés
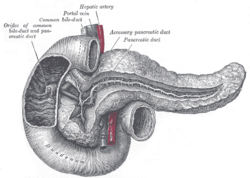
Normál anatómia
Három részre osztva: fej, test farok: [1]
- Fej:
- Tartalmazza az egyedi folyamatot.
- A felső mesenterikus vénának (SMV) bal szélére – definíció szerint.
- Az összes SMV a fejjel.
- Test:
- A jobb mesenterikus vénának jobb szélét az aorta bal széléhez – definíció szerint.
- Az összes aorta a testtel van.
- A jobb mesenterikus vénának jobb szélét az aorta bal széléhez – definíció szerint.
- Farok:
- A hasnyálmirigy többi része.
Hasnyálmirigy-műtétek
A gyakori hasnyálmirigy-műtétek a következők:
- Whipple eljárás (AKA hasnyálmirigy-donor resectio) – a duodenumot és általában a distalis gyomrot (antrum) tartalmazza.
- Distalis pancreatectomia.
- A farok +/- test eltávolítása.
- A minta általában jön a lépben.
- Tipikusan kialakult szigetsejtes daganatok.
- Teljes pancreatectomia.
- A minta általában jön a lépben.
Whipple eljárás
- MÁS NÉVENpancreaticoduodenectomy.
- A hasnyálmirigy elváltozásai, duodenális elváltozások.
- Proximális nyálkahártya-margó (gyomor vagy duodenum).
- Distalis nyálkahártya-margó (duodenum vagy jejunum).
- Csőcsatorna-maró.
- Hasnyálmirigy-retroperitoneális (koptató eljárás) marzs.
- SB kész a szélén (nem en arc).
- Hasnyálmirigy nyaki átmeneti különbözet (AKA disztális hasnyálmirigy-rezekciós határ); [3] usu. en arc és totóban. [4]
- Néha jobb mesenterikus véna (SMV).
- Ritkán jobb mezenterikus artéria (SMA) margin.
- Nyissa ki a proximális (gyomor) és a distalis (kis bél) levágott margókat.
- Nyissa fel a duodenumot az elülső oldalon lévő hosszúság mentén.
- Nyissa ki a gyomrot a nagyobb görbület mentén.
- Csatlakozzon a gyomor és a nyombél nyílásainak megnyilvánulásához.

Kommentek
Kommenteléshez kérlek, jelentkezz be: